Magnetresonanz-Grundlagen


Inhaltsverzeichnis: Grundlagen
1.1.
Einführung
1.2. Entwicklungsgeschichte
2.0. Das Magnetresonanzphänomen
2.1. Boltzmannverteilung
2.2. Magnetresonanz
2.3. T1-Relaxation
2.4. T2-Relaxation
3.0. Grundlagen der Ortskodierung
3.1. Zweidimensionales Fourier-Rekonstruktionsverfahren
3.2. Selektive Anregung
3.3. Frequenzkodierung
3.4. Phasenkodierung
3.5. Dreidimensionales Fourier-Rekonstruktionsverfahren
4.0.
Sequenzen
4.1. Spinecho-Verfahren
4.2. Gradientenecho-Verfahren
4.3. Mehrschicht-Gradientenecho-Verfahren
4.4. Sequenzparameter
5.0. Technische Komponenten
eines Magnetresonanz-Tomographen
5.1.
Magnet
5.2. Magnetische Gradienten
5.3. Hochfrequenzsender
5.4. Hochfrequenzempfänger
5.5. Signalverarbeitung
5.6. Rechenanlage
5.7. Bedienkonsole,
Auswerte- und Dokumentationseinheit
6.0. Paramagnetisches
Kontrastmittel Gd-DTPA
6.1. Physiko-chemische
Eigenschaften
6.2. Pharmakologische Eigenschaften
6.3. Unverträglichkeiten
und unerwünschte Nebenwirkungen
6.4. Kontrastmittelapplikation
7.0.
Literatur
8.0.
Verzeichnis der Abkürzungen
1.1 Einführung
Die Magnetresonanztomographie
(MRT, Synonym: Kernspintomographie (KST)) ist ein Schnittbildverfahren für
die medizinische Diagnostik, das sich in erster Linie durch ein hohes Kontrastauflösungsvermögen
auszeichnet. Aufgrund der hervorragenden Darstellbarkeit des Weichgewebes
hat sich die MRT zu einem der Röntgen-Computertomographie vielfach überlegenen
Verfahren entwickelt. Die MRT basiert heute auf der Anwendung von Spinecho-
und Gradientenecho- Sequenzen, die bei Messzeiten in der Grössenordnung
von Minuten eine exzellente Bildqualität ermöglichen. Für eine
vollständige Untersuchung müssen die Sequenzen in mehreren Schichtorientierungen
und verschiedenen Kontrastierungen wiederholt werden, so dass die Untersuchungszeit
für eine Magnetresonanztomographie zwanzig Minuten oder länger
betragen kann.
1.2. Entwicklungsgeschichte
1945 gelang es zwei Gruppen von
Physikern - PURCELL, TORREY und POUND an der Harvard Universität sowie
BLOCH, HANSEN und PACKARD an der Stanford Universität - unabhängig
voneinander, das Phänomen der magnetischen Kernresonanz an festen und
flüssigen Substanzen zu beobachten. Bereits Anfang der fünfziger
Jahre wurde die magnetische Kernresonanz auf Probleme der Chemie und Physik
angewendet. Besondere Bedeutung erlangte die Methode der magnetischen Kernresonanz-Spektroskopie
für die Analyse chemischer Verbindungen und chemischer Reaktionsabläufe.
Im Jahr 1973 wurde durch LAUTERBUR erstmals ein Verfahren zur Bildgebung
mit Hilfe der magnetischen Kernresonanz vorgestellt. Die grundlegende Idee
LAUTERBUR´s war die Einführung magnetischer Gradientenfelder zur
Ortskodierung der Kernresonanzsignale. Die Tomographie mit Hilfe der Magnetresonanz
ist seitdem mit der Entwicklung stärkerer und homogenerer supraleitender
Magnete, der Elektronik und der Computertechnik zu einem der leistungsfähigsten
bildgebenden Verfahren in der medizinischen Diagnostik gereift und hat das
Potential, Röntgenuntersuchungen zu verdrängen.
2.0. Das Magnetresonanzphänomen
Das Magnetresonanzphänomen
ist durch den Wechsel der Energiezustände der Kernspins unter Austausch
von Hochfrequenzenergie gekennzeichnet. Bei jedem Magnetresonanzexperiment
wird Hochfrequenzenergie in eine Probe eingestrahlt und kurz darauf die
von der Probe ausgehende Hochfrequenzantwort registriert. Die Voraussetzung
für das Magnetresonanzphänomen wird durch ein äusseres Magnetfeld
geschaffen, durch das für die Atomkerne aufgrund ihres Kernspins verschiedene Energiezustände entstehen.
Durch einen Hochfrequenzimpuls mit Resonanzfrequenz wird den Atomkernen
Energie zugeführt. Die Atomkerne werden auf ein höheres Energieniveau
angehoben. Nach dem Abschalten der Energiezufuhr fallen die Atomkerne auf
das niedrigere Energieniveau zurück und geben die aufgenommene Energie
wieder in Form eines Hochfrequenzsignals ab.
Für ein tieferes Verständnis
des Magnetresonanzphänomens sind die Grundlagen im folgenden Text eingehender
erläutert. Die physikalische Grundlage der magnetischen Kernresonanz
ist der Kernmagnetismus. Der Kernmagnetismus beruht auf der Tatsache, dass
die elektrisch geladenen Kernteilchen eine Rotationsbewegung ausführen.
Da bewegte elektrische Ladungen ein Magnetfeld verursachen, besitzt jedes
Kernteilchen ein magnetisches Moment. Wenn im Atomkern eine ungerade Zahl
von Kernteilchen vorliegt, wird das magnetische Moment der Kernteilchen nach
aussen wirksam. Bei gerader Kernteilchenzahl neutralisieren sich die magnetischen
Momente der Kernteilchen, so dass nach aussen kein Kernmagnetismus messbar
wird. Für die magnetische Kernresonanz kommen also nur Atomkerne mit
ungerader Kernteilchenzahl in Betracht. Solche Atome mit ungerader Kernteilchenzahl
sind z.B. Wasserstoff (1H), Kohlenstoff (13C), Natrium (23Na) und Phosphor
(31P).
Bisher ist bei der Magnetresonanztomographie
nahezu ausschliesslich der Kernmagnetismus der im Gewebe sehr zahlreich
vorhandenen Wasserstoffatome genutzt worden. Nach der Quantentheorie verhält
sich ein Wasserstoffatomkern wie ein rotierender Kreisel, der einen Drehimpuls
um seine Rotationsachse besitzt, den sogenannten Kernspin oder genauer Spindrehimpuls.
Die Rotationsachsen der Kernspins folgen dem Prinzip der maximalen Entropie
und nehmen zufällige und ungeordnete Orientierungen im Raum ein (Abb.
1a). Wenn die Kernspins in ein statisches Magnetfeld gebracht werden, werden
die Rotationsachsen der Kernspins aufgrund der Wechselwirkung zwischen dem
äusseren Magnetfeld und dem Kernmagnetismus in eine Ordnung gezwungen.
Die Rotationsachsen der Kernspins richten sich entlang der Feldlinien des
äusseren Magnetfeldes aus. Die Kernspins werden gewissermassen im äusseren
Magnetfeld polarisiert (Abb. 1b).
Abb. 1a: Entropie der Kernmagnete ohne Magnetfeld

Zufällige Orientierung der Rotationsachsen
der Kernspins bei Raumbedingungen. Die Rotationsachsen der Kernspins, bzw.
die magnetischen Momente der Kernspins, sind durch Vektoren symbolisiert.
Die Ausrichtung der Rotationsachsen ist aufgrund thermischer Einflüsse
ungeordnet. Die Abbildung entspricht einer Momentaufnahme. Die Ausrichtung
der magnetischen Momente der Kernspins ist ständigen Änderungen
unterworfen.
Abb. 1b: Ausrichtung der Kernmagnete im Magnetfeld
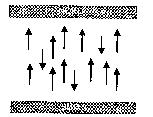
Polarisation der Rotationsachsen der Kernspins
bei Einwirkung eines starken statischen Magnetfeldes. Die Rotationsachsen
der Kernspins bzw. die magnetischen Momente der Kernspins richten sich wie
Kompassnadeln entlang der magnetischen Feldlinien aus. Die Abbildung idealisiert
das Ausmass der Polarisation. Bei den gebräuchlichen magnetischen Flussdichten
(0,5 bis 1,5 Tesla) ist nur ein geringer (circa millionstel) Anteil der Spins
polarisiert.
2.1. Boltzmannverteilung
In Abhängigkeit von der
Stärke des Magnetfeldes und der Temperatur entsteht ein Gleichgewicht
zwischen der ordnenden Wirkung des Magnetfeldes und der in Unordnung bringenden
Wirkung der Temperatur. Das zahlenmässige Verhältnis zwischen polarisierten
Kernspins und nicht polarisierten Kernspins wird durch die Boltzmannverteilung
beschrieben. Die Boltzmannverteilung ist nach der folgenden Beziehung berechenbar:
(Gleichung 1)
N polar. / N nicht polar.
= exp (h * y * Bo / (k * T))
mit:
N polar. = Anzahl der
polarisierten Kernspins
N nicht polar. = Anzahl der
nicht polarisierten Kernspins
h = Plancksches
Wirkungsquantum (Konstante)
y = gyromagnetisches
Verhältnis (Stoffkonstante)
Bo = magnetische Flussdichte
k = Boltzmannkonstante
T = absolute Temperatur
Bei Raumtemperatur und magnetischen
Flussdichten in der Grössenordnung von einem Tesla, d.h. bei Bedingungen
wie sie an gebräuchlichen MR-Tomographen gegeben sind, ist die Boltzmannverteilung
extrem in Richtung der Nichtpolarisation verschoben. Von einer Million Kernspins
sind bei diesen Bedingungen nur circa sieben polarisiert. Nur diese sieben
polarisierten Kernspins tragen zur Magnetresonanz und letztendlich zur Bildgebung
bei. Die Summe der einzelnen polarisierten Kernmagnete wird Längsmagnetisierung
genannt.
2.2. Magnetresonanz
Die im äusseren Magnetfeld
polarisierten Kernspins besitzen ein niedrigeres Energieniveau als die nicht
polarisierten Kernspins. Bei der magnetischen Kernresonanz wird den polarisierten
Kernspins durch einen kurzen Hochfrequenzimpuls Energie zugeführt. Die
polarisierten Kernspins werden durch den Hochfrequenzimpuls angeregt. Bei
der Anregung werden die zuvor polarisierten Kernspins aus ihrer Ausgangslage
gekippt, so dass sie mit einer zur Feldstärke des äusseren Magnetfeldes
proportionalen Frequenz präzedieren. Die rotierenden Kerne rufen durch
ihren Kernmagnetismus eine Magnetisierung senkrecht zur Hauptpolarisationsrichtung
hervor. Diese transversale oszillierende Magnetisierungskomponente (Quermagnetisierung)
kann eine Spannung in einer Empfangsantenne induzieren, die sich verstärken,
messen und auf ihre Frequenzanteile hin analysieren lässt. Man spricht
bei diesem Vorgang von Kernresonanz oder Magnetresonanz, weil der Energieaustausch
zwischen Umgebung und Kernspin nur mit einer ganz bestimmten kernspezifischen
Resonanzfrequenz erfolgen kann. Nur wenn der verwendete Hochfrequenzimpuls
die Resonanzfrequenz des Kerns besitzt, kann eine Energieübertragung
auf den Kernspin stattfinden. Die Resonanzfrequenz wird Larmorfrequenz genannt.
Die Larmorfrequenz ergibt sich aus dem Produkt von magnetischer Flussdichte
des äusseren Magnetfeldes und dem gyromagnetischen Verhältnis,
welches eine Stoffkonstante ist. Verschiedene Atomkerne haben verschiedene
Larmorfrequenzen.
(Gleichung 2)
Larmorfrequenz = Bo .
y (Produkt
aus Bo und y)
y = gyromagnetisches
Verhältnis (Stoffkonstante)
Bo = Magnetische Flussdichte
des Grundmagnetfeldes
Larmorfrequenzen verschiedener Atomkerne
| Atomkern |
Larmorfrequenz
(MHz / 0,5 T) |
Larmorfrequenz
(MHz / 1 T) |
| 1H |
21,29 |
42,58 |
| 2D |
3,27 |
6,53 |
| 13C |
5,36 |
10,71 |
| 19F |
20,03 |
40,05 |
| 23Na |
5,63 |
11,26 |
| 31P |
8,62 |
17,23 |
| 39K |
1,00 |
1,99 |
Tabelle der Larmorfrequenzen
verschiedener Atomkerne. Die Larmorfrequenzen sind für magnetische
Flussdichten von 0,5 und 1,0 Tesla angegeben.
Für die klinische MRT wird
nahezu ausschliesslich die Wasserstoffprotonenresonanz verwendet. Die Larmorfrequenz
für Wasserstoff beträgt bei einer magnetischen Flussdichte von
1,0 Tesla 42,58 MHz. Die Frequenzen für die Protonenresonanz liegen
im Kurzwellenbereich (circa 7 m Wellenlänge).
2.3. T1-Relaxation
Den Vorgang der Polarisation
der Kernspins längs der Magnetfeldlinien des äusseren Magnetfeldes
nennt man T1-Relaxation (Abb. 2a). Die T1-Relaxation wird auch als longitudinale
Relaxation bezeichnet, da die Ausrichtung der Kernspins längs des von
aussen angelegten Magnetfeldes erfolgt (Längsmagnetisierung). Die T1-Relaxation
ist abgeschlossen, wenn der Anteil der polarisierten Kernspins dem Verhältnis
der Boltzmannverteilung entspricht.
Abb. 2a: T1-Relaxation
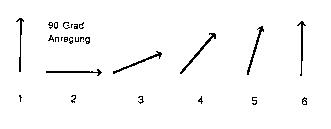
In einem äusseren statischen Magnetfeld
sind die Kernspins längs der Magnetfeldlinien ausgerichtet (in der
Abbildung vertikal (1)). Nach einem 90 Grad Hochfrequenzanregungsimpuls wird
die Magnetisierung der Kernspins um 90 Grad in die Horizontale rotiert (2).
Unmittelbar danach richtet sich die Summe der Magnetisierung der Kernspins
wieder mit einer zeitlichen Verzögerung (T1-Relaxationszeit) längs
der Magnetfeldrichtung aus (3 bis 6).
2.3.1. T1-Relaxationszeit
Die Dauer der T1-Relaxation wird
durch eine Zeitkonstante - die T1-Relaxationszeit - beschrieben (Abb. 2b).
Die Dauer der T1-Relaxationszeit ist abhängig von der magnetischen
Flussdichte, der Temperatur und darüber hinaus entscheidend abhängig
von der Qualität des relaxierenden Stoffes. Die T1-Relaxationszeiten
liegen für Flüssigkeiten bei magnetischen Flussdichten von einem
Tesla und unter Normalbedingungen im Grössenbereich von Sekunden und
für Weichteilgewebe im Bereich von Zehntelsekunden.
Abb. 2b: T1-Relaxationszeit
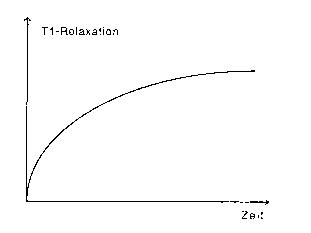
Die Zahl der ausgerichteten bzw. relaxierten Kernspins
folgt in Abhängigkeit von der Zeit einer exponentiellen Sättigungsfunktion.
Die Steigung der Funktion ist durch die T1-Relaxationszeit bestimmt.
2.3.2. T1-gewichteter Bildkontrast
Die T1-Relaxationszeit hat einen
wesentlichen Einfluss auf die Signalintensitäten und Bildkontraste
bei der Magnetresonanztomographie. Man spricht bei Aufnahmen mit einem hohen
Anteil an T1-relaxationszeitbedingtem Bildkontrast von T1-gewichteten Aufnahmen.
Auf T1-gewichteten Aufnahmen haben Gewebe mit kurzen T1-Relaxationszeiten
(z.B. Fett, kontrastmittelanreichernde Strukturen) eine hohe Signalintensität.
Umgekehrt haben Stoffe mit langen T1-Relaxationszeiten (z.B. Wasser, Liquor)
eine niedrige Signalintensität. Das normale Marklager des Gehirns ist
z.B. gegenüber der Hirnrinde auf T1-gewichteten Aufnahmen signalintensiver,
weil das Marklager kürzere T1-Relaxationszeiten als die Rinde aufweist.
In der Regel sind krankhafte Gewebsveränderungen wegen ihrer verlängerten
T1-Relaxationszeiten auf T1-gewichteten Aufnahmen signalärmer als das
normale Gewebe abgebildet.
2.4. T2-Relaxation
Bei der Magnetresonanz präzedieren
die angeregten Kernspins um die Längsachse des statischen Magnetfeldes.
Unmittelbar nach der Anregung durch einen Hochfrequenzimpuls ist die Präzession
aller Kernspins zunächst synchron. Die magnetischen Momemte der einzelnen
Kernspins addieren sich zu einer messbaren Grösse (Quermagnetisierung).
Mit zunehmender Zeit nach dem Hochfrequenzimpuls treten Desynchronisationen
bzw. Dephasierungen der einzelnen Kernspins zueinander auf. Die Ursache
hierfür ist in geringen Magnetfelddifferenzen durch unterschiedliche
molekulare Nachbarschaftsbeziehungen und Wechselwirkungen der einzelnen Kernspins
begründet. Durch die Magnetfeldinhomogenitäten differieren die
Larmorfrequenzen der Spins geringfügig, so dass sie auseinanderrotieren
bzw. dephasieren. Die magnetischen Momemte der dephasierten Kernspins können
sich dann gegenseitig auslöschen und sind dann nicht mehr nachweisbar.
Den Vorgang der Dephasierung
der Kernspins durch ihre Wechselbeziehung untereinander nennt man T2-Relaxation.
Die T2-Relaxation wird auch als transversale Relaxation bezeichnet, da die
Dephasierung der Kernspins transversal oder quer zum äusseren Magnetfeld
erfolgt. Die T2-Relaxation ist abgeschlossen, wenn die Kernspins so weit dephasiert
sind, dass die Quermagnetisierungskomponenten der einzelnen Spins sich gegenseitig
vollständig neutralisieren (Abb. 3a).
Abb. 3a: T2-Relaxation
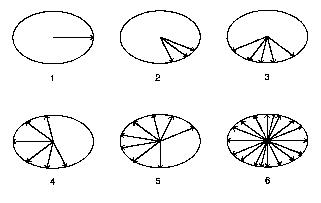
Nach der Anregung durch einen Hochfrequenzimpuls
werden die magnetischen Momente der Kernspins in die Quermagnetisierungsebene
ausgelenkt und zeigen zunächst alle in die selbe Richtung (1). Die
Beträge der einzelnen magnetischen Momente summieren sich zu diesem
Zeitpunkt zu einer messbaren Grösse. Die magnetischen Momente der Kernspins
rotieren mit gering unterschiedlicher Umdrehungsgeschwindigkeit und laufen
mit zunehmender Zeit mehr und mehr auseinander (2,3,4). Da nach einer gewissen
T2-Relaxationszeit einige Magnetvektoren gegeneinander ausgerichtet sind,
löschen sich ihre Magnetkomponenten gegenseitig aus (4,5,6). Am Ende
(6) verschwindet die Quermagnetisierung bzw. das von aussen messbare Kernspinresonanzsignal.
2.4.1. T2-Relaxationszeit
Die Dauer der T2-Relaxation wird
durch eine Zeitkonstante - die T2-Relaxationszeit - beschrieben (Abb. 3b).
Die T2-Relaxationszeit ist von physikalischen Grössen (z.B. Temperatur,
Druck) und von der Gewebequalität des resonanzgebenden Stoffes abhängig.
Die T2-Relaxationszeit ist immer kürzer als die T1-Relaxationszeit
und liegt für Flüssigkeiten bei magnetischen Flussdichten von einem
Tesla im Grössenbereich von bis zu mehreren Sekunden und für Weichteilgewebe
in der Grössenordnung von Zehntelsekunden.
Abb. 3b: T2-Relaxationszeit
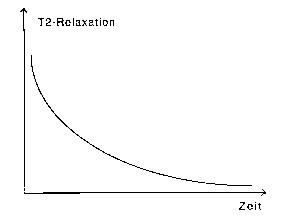
Nach der Anregung durch einen Hochfrequenzimpuls
verschwindet die transversale Magnetisierung, bzw. das von aussen messbare
Magnetresonanzsignal mit zunehmender Dephasierung der Kernspins. Der Signalabfall
folgt einer exponentiell abfallenden Funktion, deren Verlauf durch die T2-Relaxationszeit
bestimmt wird.
2.4.1.0. T2*-Relaxationszeit
Bei Gradientenecho-Sequenzen
ist im Vergleich zu den Spinecho-Sequenzen der exponentielle Signalabfall
verkürzt. Die Ursache hierfür ist, dass sich bei der Gradientecho-Technik
Einflüsse von aussen (z.B. Inhomogenitäten des äusseren statischen
Magnetfeldes) störend auswirken können und zu einer beschleunigten
Dephasierung der Kernspins führen. Der Signalabfall bzw. die Dephasierung
der Kernspins bei Gradientenecho-Aufnahmen wird durch die T2*(T2-Stern)-Relaxationszeit
beschrieben. Die T2*-Relaxationszeit ist im Gegensatz zu der T2-Relaxationszeit
nicht nur dominierend durch die Gewebeeigenschaften bestimmt, sondern auch
von Geräteeigenschaften abhängig. Die T2*-Relaxationszeit ist
im Vergleich mit mit der T2-Relaxationszeit immer kürzer.
2.4.2. T2-gewichteter Bildkontrast
Die T2-Relaxationszeit hat ebenso
wie die T1-Relaxationszeit einen wesentlichen Einfluss auf die Signalintensitäten
und Bildkontraste in der Magnetresonanztomographie. Man spricht bei Aufnahmen
mit einem hohen Anteil an T2-relaxationszeitbedingtem Bildkontrast von T2-gewichteten
Aufnahmen. Auf T2-gewichteten Aufnahmen haben Gewebe mit kurzen T2-Relaxationszeiten
(z.B. Hirngewebe) eine niedrige Signalintensität. Stoffe mit langen T2-Relaxationszeiten
(z.B. Wasser, Liquor) zeigen dagegen eine hohe Signalintensität. Aufgrund
geringfügig niedrigerer T2-Relaxationszeiten des Marklagers gegenüber
der Hirnrinde ist das normale Marklager auf T2-gewichteten Aufnahmen signalärmer
als die Rinde dargestellt. In der Regel sind erkrankte Gewebsanteile wegen
ihrer verlängerten T2-Relaxationszeiten auf T2-gewichteten Aufnahmen
signalintensiver als das normale Gewebe abgebildet (Abb. 4a,b).
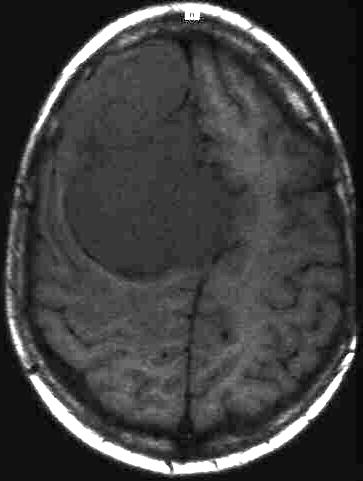
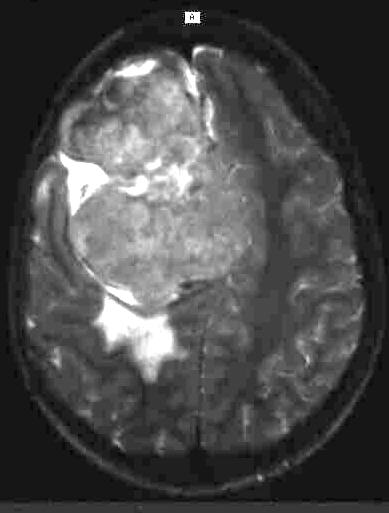
Abbildungen 4 a,b
T1-gewichtetes transversales Magnetresonanztomogramm
(SE 500/15) links im Vergleich mit einem T2-gewichteten MRT (SE 2500/90)
eines hochfrontalen Meningeomes. Der Tumor ist auf der T1-gewichteten Aufnahme
(4 a, links) signalarm im Gegensatz zu der hohen Signalintesnsität des
Tumors auf dem T2-gewichteten Bild (4 b, rechts). Die unterschiedlichen Kontraste
sind aufgrund verschiedener physikalischer Gewebeeigenschaften bedingt.
3.0. Grundlagen der Ortskodierung
Bei der Magnetresonanzuntersuchung
wird die Summe aller Magnetresonanzsignale einer Probe registriert. Um ein
Bild oder Tomogramm zu erzeugen, müssen die Resonanzsignale verschiedenen
räumlichen Ursprungs so kodiert werden, dass sie voneinander getrennt
und ihrem Ursprungsort zugeordnet werden können.
Die grundlegende Idee zur Ortskodierung
stammte von LAUTERBUR. Das Prinzip basiert auf dem festen linearen Zusammenhang
zwischen der Larmorfrequenz der Kernspins
und der magnetischen Flussdichte. Angenommen das magnetische Feld wäre
an jedem Ort innerhalb der Probe verschieden stark, so hätte jeder
Kernspin eine andere Resonanzfrequenz. Die von unterschiedlichen Orten stammenden
Signalbeiträge wären dann durch eine Frequenzanalyse voneinander
zu trennen. Bei der Magnetresonanz-Tomographie werden zur Ortskodierung magnetische
Gradientenfelder verwendet, die zusätzlich zum statischen Magnetfeld
einwirken und sich diesem überlagern. Diese sogenannten Gradienten können
variabel in allen drei Raumrichtungen in schneller Folge ein und ausgeschaltet
werden.
3.1. Zweidimensionales Fourier-Rekonstruktionsverfahren
Das zweidimensionale Fourier-Rekonstruktionsverfahren
ist das Standardverfahren zur Rekonstruktion von Magnetresonanztomogrammen.
Beim zweidimensionalen Fourier-Rekonstruktionsverfahren wird eine Raumrichtung
durch eine selektive Schichtanregung kodiert, die zweite Raumrichtung durch
eine Phasenkodierung bestimmt und die dritte Raumdimension mit Hilfe einer
Frequenzkodierung rekonstruiert. Die gemessenen Rohdaten entsprechen dem
Frequenzspektrum der Aufnahme (Abb. 5 a,b).


Abbildungen: 5 a,b
Abbild der Rohdaten (links) einer Magnetresonanztomographie
des Gehirns (rechts). Zwischen den beiden Abbildungen steht die mathematische
Operation der Fouriertransformation. Beide Abbildungen verfügen über
den gleichen Informationsgehalt.
3.2. Selektive Anregung
Die selektive Anregung der Kernspins
wird zur gezielten Auswahl einer Schicht eingesetzt. Hierzu wird ein magnetisches
Gradientenfeld senkrecht zu der gewünschten Schichtebene angelegt.
Wegen des magnetischen Gradienten haben die verschiedenen Schichtebenen entlang
des sogenannten Schichtselektionsgradienten unterschiedliche Resonanzfrequenzen.
Zur selektiven Anregung einer Schicht wird dann ein Hochfrequenzimpuls mit
einem schichtspezifischen Resonanzspektrum eingesetzt. Die Breite des Frequenzspektrums
und die Amplitude des Schichtselektionsgradienten bestimmen dabei die Schichtdicke,
der mittlere Frequenzversatz die Schichtposition.
3.3. Frequenzkodierung
Die Ortskodierung der Spins innerhalb
einer Schicht erfolgt durch eine Frequenz- und eine Phasenkodierung. Zur
Frequenzkodierung wird während der Messung des Resonanzsignals dem statischen
Magnetfeld ein magnetischer Gradient überlagert, so dass die Kernspins
entlang des Gradienten unterschiedliche Resonanzfrequenzen abstrahlen. Durch
eine Frequenzanalyse mit Hilfe des Fourier-Algorhythmus können die Frequenzanteile
des Resonanzsignals in der Raumrichtung des Frequenzkodiergradienten (auch
Lesegradient genannt) lokalisiert werden.
3.4. Phasenkodierung
Zur Phasenkodierung wird ebenfalls
ein magnetischer Gradient - der Phasenkodiergradient - eingesetzt. Der Phasenkodiergradient
ist in seiner Ausrichtung orthogonal zu den Frequenz- und Schichtselektionsgradienten.
Der Phasenkodiergradient wird für eine kurzen Zeitraum unmittelbar nach
dem Anregungsimpuls eingeschaltet. In diesem Zeitraum haben die Spins entlang
des Phasenkodiergradienten unterschiedliche Rotationsfrequenzen. Die Spins
rotieren auseinander, es entstehen Phasenverschiebungen. Je länger der
Phasenkodiergradient einwirkt desto grösser ist die Phasenverschiebung
der einzelnen Kernspins zueinander. Die Phasenverschiebung bleibt auch nach
dem Abschalten des Phasenkodiergradienten erhalten und kann nachträglich
durch eine Phasenanalyse in eine Ortsinformation umgerechnet werden. Die Phasenkodierung
der Kernspins erfolgt kurz vor der Frequenzkodierung und ist vor dem Beginn
der Messung des Resonanzsignals bereits abgeschlossen. Bei einer Matrix von
512 x 512 Bildpunkten sind zur Kodierung der Phaseninformation 512 Wiederholungen
(Pulswiederholungen oder Repetitionen) der Echoerzeugung mit unterschiedlichen
Amplituden des magnetischen Phasenkodiergradienten erforderlich.
3.5. Dreidimensionales Fourier-Rekonstruktionsverfahren
Das dreidimensionale Fourier-Rekonstruktionsverfahren
ist im Vergleich zum zweidimensionalen Fourier-Rekonstruktionsverfahren
in der dritten Raumebene, der Schichtselektionsrichtung, durch eine
zusätzliche zweite Phasenkodierung ergänzt. Beim dreidimensionalen
Fourier-Rekonstruktionsverfahren werden zwei Raumrichtungen durch Phasenkodierungen
bestimmt und die dritte Raumdimension mit Hilfe der Frequenzkodierung rekonstruiert.
4.0. Sequenzen
Die Sequenz bestimmt in der Magnetresonanztomographie
den Ablauf einer MR-Untersuchung (z.B. Festlegung der Zahl, Dauer und Folge
von Hochfrequenzimpulsen und Gradientenschaltungen). Eine Sequenz ist durch
das verwendete Sequenzverfahren und durch ihre Sequenzparameter definiert.
Das System der Wasserstoffatomkerne kann durch zahlreiche unterschiedliche
Sequenzverfahren zur Magnetresonanz gebracht werden. Im folgenden werden
nur das Spinecho- und das Gradientenechoverfahren beschrieben.
4.1. Spinechoverfahren
Das Spinechoverfahren hat sich
in der klinischen MRT als Standardverfahren etabliert. Das entscheidende
Merkmal der Spinechotechnik ist, dass nach einen 90 Grad Hochfrequenzanregungsimpuls
ein Spinecho durch einen 180 Grad Invertierungsimpuls ausgelöst wird
(Abb. 6).
Abb. 6
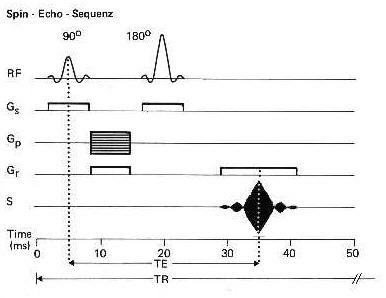
RF - Hochfrequenzimpuls
Gs - Schichtselektionsgradient
Gp - Phasenkodiergradient
Gr - Frequenzkodiergradient
S - Magnetresonanzsignal
Diagramm der Anregungspulse, Gradientenschaltungen
und der Echoentstehung für die Spinechotechnik. Bei der Spinechosequenz folgt dem 90 Grad-Anregungspuls
eine dephasierende Gradientenschaltung (Gr). Nach dem Abschalten des Gradienten
(Gr) bleibt eine Phasenverschiebung bestehen. Der 180 Grad Hochfrequenzimpuls
bewirkt eine Invertierung der Phasenverschiebung. Wird der Gradient (Gr) nochmals
in gleicher Weise wie zuvor eingeschaltet wirkt er rephasierend. So wird
die Phasenverschiebung betragsmässig wieder reduziert. Zum Zeitpunkt
der vollständigen Rephasierung (in diesem Beispiel bei 35 ms) ist die
Refokussierung der Kernspins zum Spinecho vollzogen.
Abb. 7

RF - Hochfrequenzimpuls
Gs - Schichtselektionsgradient
Gp - Phasenkodiergradient
Gr - Frequenzkodiergradient
S - Magnetresonanzsignal
Diagramm der Anregungspulse, Gradientenschaltungen
und des Phasenverlaufs der Kernspins für die Gradientenechotechnik.
Bei der Gradientenechosequenz folgt dem 90 Grad Anregungspuls ebenfalls eine
dephasierende Gradientenschaltung (Gr), die im Vergleich zur Spinechosequenz
(siehe Abb. 6) jedoch invertiert ist. Der 180 Grad Hochfrequenzimpuls fehlt.
Die Rückführung der Phasenverschiebung und die Erzeugung des Gradientenechos
wird durch die Umkehrung des Lesegradienten (Gr) erreicht.
4.2. Gradientenechoverfahren
Das Gradientenechoverfahren bildet
die Grundlage vieler Schnellbildverfahren. Im Gegensatz zum Spinechoverfahren
wird beim Gradientenechoverfahren die Echoauslösung nicht durch einen
180 Grad Hochfrequenzimpuls sondern durch die Umkehr der Ausrichtung des
Frequenzkodiergradienten erreicht (Abb. 7). Bei Anwendung von Anregungswinkeln
kleiner als 90 Grad wird das Gradientenechoverfahren auch als FLASH-Technik
(Fast Low Angle SHot) oder FFE-Technik (Fast Field Echo) bezeichnet.
4.3. Mehrschichtverfahren
Das Mehrschichtverfahren ist
sowohl für Spinecho- als auch für Gradientenechosequenzen anwendbar.
Durch das Mehrschichtverfahren ist es möglich geworden, mit einer Messung
nicht nur eine einzelne Schicht, sondern gleichzeitig multiple Schichten abzubilden.
Das Mehrschichtverfahren führte zu einer deutlichen Beschleunigung der
Bilderstellung in der MRT. Der Zeitgewinn in Verbindung mit dem Mehrschichtverfahren
ist abhängig von der maximalen Schichtanzahl, die quasi simultan gemessen
werden kann. Bei der Mehrschichtgradientenechosequenz können im Vergleich
mit der Mehrschichtspinechosequenz deutlich mehr Schichten bei gleicher Pulswiederholzeit
gemessen werden. Durch das verschachtelte Aneinanderreihen mehrerer Einzelschichtmessungen
ist die Gradientenechotechnik in ein Mehrschichtverfahren überführbar.
Dabei werden in jeder Schicht nicht nacheinander alle Pulswiederholungen (für
eine 512 er Bildmatrix sind 512 Wiederholungen erforderlich) durchgeführt,
sondern bei jeder Pulswiederholung erfolgt nacheinander für alle Schichten
die selektive Anregung und unmittelbare Auslesung des Gradientenechos (Abb.
8). Da Anregung und Auslesung jeweils nur wenige Milisekunden dauern, können
viele Schichten in kurzer Zeit gemessen werden. Die minimal mögliche
Pulswiederholzeit (TR), d.h. die Zeit zwischen zwei Anregungen derselben
Schicht, verlängert sich beim Mehrschichtverfahren proportional mit
der Anzahl der Schichten.
Abb. 8: Mehrschicht-Gradientenecho-Verfahren
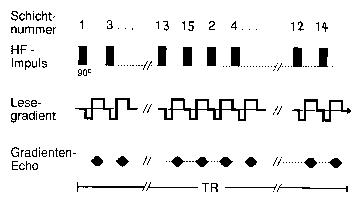
Zeitdiagramm der Mehrschichtgradientenechosequenz.
Die Schichten werden durch selektive Anregungsimpulse sukzessiv gemessen.
Die Schichtreihenfolge wird verschachtelt, um die Beeinflussung benachbarter
Schichten zu reduzieren. Die Pulswiederholzeit TR muss genügend gross
sein, um die gewünschte Schichtanzahl messen zu können.
4.4. Sequenzparameter
Während durch das Sequenzverfahren
die Folge der Hochfrequenz- und Gradientenschaltungen qualitativ festgelegt
ist, können durch die Sequenzparameter die Zeitabstände und Amplituden
der Hochfrequenz- und Gradientenschaltungen quantitativ verändert werden.
Die Sequenzparameter können durch den Anwender am Magnetresonanztomographen
vor jeder Messung in weiten Bereichen frei gewählt werden. Die Sequenzparameter
haben einen wesentlichen Einfluss auf das Bildergebnis und müssen den
klinischen Erfordernissen angepasst werden. Zu den wichtigsten Sequenzparametern
gehören die Zeitkonstanten der Pulswiederholzeit (TR für time
repetition) und der Echoausleseverzögerung (TE für time echo delay).
Weitere Sequenzparameter sind die Echoauslesedauer, der Anregungswinkel alpha,
die Anzahl der Datenakquisitionen, die Messmatrix, die Schichtdicke, die
Schichtanzahl und der Schichtabstand. Darüber hinaus existieren noch
weitere Sequenzparameter auf die hier nicht näher eingegangen wird.
4.4.1. Pulswiederholzeit
Die Pulswiederholzeit TR beschreibt
die Dauer zwischen zwei Hochfrequenzanregungsimpulsen (Abb. 10).
4.4.2. Echoausleseverzögerung
Die Echoausleseverzögerung
TE gibt die Zeitverzögerung an, die zwischen der Anregung der Kernspins
und der Echoauslesung verstreicht (Abb. 9).
4.4.3. Echoauslesedauer
Die Echoauslesedauer entspricht
dem Zeitraum in dem das Magnetresonanzsignal registriert wird (Abb. 8).
Der Begriff der Echoauslesedauer darf nicht mit der Echoausleseverzögerung
verwechselt werden. Nach dem Anregungsimpuls beginnt zuerst der Zeitraum
der Echoausleseverzögerung und danach erst der Zeitraum der Echoauslesedauer.
Abb. 9: Sequenzparameter TR und TE bei
einer Gradientenecho-Sequenz

Die Pulswiederholzeit TR bestimmt die Dauer zwischen
zwei Anregungsimpulsen. Die Echoausleseverzögerung TE entspricht der
Verzögerung zwischen dem Anregungsimpuls alpha und der Echoauslesung.
Die Echoauslesedauer entspricht der Einschaltdauer des Lesegradienten bzw.
der Zeit, in der das Magnetresonanzsignal aufgezeichnet wird.
4.4.4. Anregungswinkel
Der Anregungswinkel ist ein Mass
für die mit dem Hochfrequenzanregungsimpuls auf die Kernspins übertragene
Energie. Grosse Anregungswinkel kennzeichnen eine hohe Energieübertragung.
Der Anregungswinkel beschreibt in welchem Winkel ein Hochfrequenzanregungsimpuls
die Kernspins aus ihrer Hauptpolarisationsachse (entlang des äusseren
Magnetfeldes) auslenkt. Ein Anregungswinkel von z.B. 90 Grad kippt die Kernspins
so weit aus ihrer Ursprungslage, dass sie nach der Anregung senkrecht zu ihrer
ursprünglichen Ausrichtung orientiert sind. Bei der Spinecho-Sequenz
werden fest eingestellte Anregungswinkel von 90 und 180 Grad verwendet.
Bei Gradientenecho-Sequenzen kann durch eine Optimierung (in der Regel Reduktion)
des Anregungswinkels ein Signalgewinn erreicht werden.
4.4.5. Datenakquisitionen
Durch mehrfache Datenakquisitonen
(wiederholte Messungen) und Aufsummierung der Messwerte können die
Signalamplituden erhöht und die zufälligen störenden Rauschsignale
reduziert werden. Die theoretische Begründung hierfür ist, dass
die Vorzeichen und die Amplituden der Rauschsignalintensitäten statistisch
um die Nullage normalverteilt sind. Mit zunehmender Zahl gemittelter Rauschsignalintensitäten
nähert sich der Mittelwert der Rauschsignalintensitäten dem Nullwert
an. Durch die Anzahl der Datenakquisitionen ist die Bildqualität theoretisch
beliebig steigerbar. Daher muss die Anzahl der Datenakquisitionen bzw. die
Messzeit bei der Beurteilung der Bildqualität stets Berücksichtigung
finden (Abb. 10 a,b). Die Anwendung vermehrter Datenakquisitionen hat den
Nachteil, dass die Messzeit mit der Zahl der Datenakquisitionen linear ansteigt.
Dagegen verringert sich das Rauschen nicht linear, sondern nur mit der Quadratwurzel
der Zahl der Datenakquisitionen.
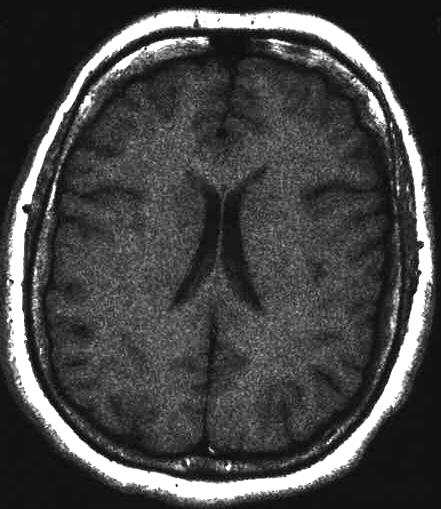

Abbildungen: 10 a,b
Einfluss vermehrter Datenakquisitionen auf die
Bildqualität. T1-gewichtetes transversales MRT des Gehirns in Ventrikelebene.
Links Messzeit eine Minute bei einer Datenakquisition,
rechts Messzeit vier Minuten bei vier Datenakquisitionen. Das Kontrast-zu-Rausch-Verhältnis
kann durch verlängerte Mess- und Untersuchungszeiten gesteigert (rechtes
Bildbeispiel) werden. Der Kontrast zwischen Marklager und Hirnrinde ist
auf der rechten Aufnahme mit verlängerter Messzeit höher.
4.4.6. Messmatrix
Die Messmatrix bestimmt die Anzahl
der Messpunkte und beeinflusst das räumliche Auflösungsvermögen.
Die üblichen Messmatrizes sind quadratisch, z.B. 128 x 128, 256 x 256,
512 x 512 oder 1024 x 1024 Messpunkte. Die Grösse der Messmatrix geht
linear in die Messzeit ein. Häufig werden heute Matritzen von 2562
oder 5122 verwendet.
4.4.7. Schichtdicke, -anzahl, -abstand
Die Schichtdicke kann theoretisch
durch die Änderung der HF-Anregungsimpulsform und des Schichtselektionsgradienten
in weiten Bereichen variiert werden. In der Praxis sind die verwendeten
Schichtdicken jedoch auf einen engen kompromissbedingten Bereich beschränkt,
der durch das zunehmende räumliche Auflösungsvermögen und
das abnehmende Resonanzsignal bei abnehmender Schichtdicke bestimmt wird.
Bei Mehrschichtsequenzen kann eine von der Pulswiederholzeit abhängige
maximale Schichtanzahl gewählt werden. Bei einem grossen Untersuchungsvolumen
wird dadurch die Schichtdicke zwangsläufig grösser. Zwischen den
Schichten können beliebige Schichtabstände bzw. Lücken eingestellt
werden. Typische Schichtdicken betragen zwischen 2 und 8 mm.
5.0. Technische Komponenten eines Magnetresonanz-Tomographen
Die Hauptkomponenten eines MR-Tomographen
sind: ein starker Magnet, magnetische Gradientenfelder, ein Hochfrequenzsender,
ein Hochfrequenzempfänger, eine Signalverarbeitungsanlage, ein Rechner,
eine Bedienkonsole und eine Auswerte- und Dokumentationseinheit (Abb. 11).
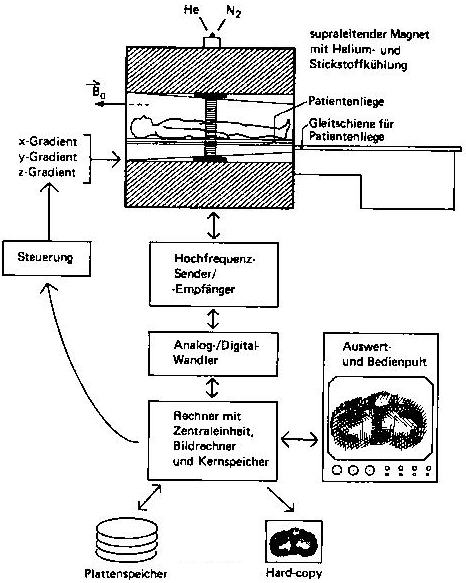
Abb. 11
Hauptkomponenten eines Magnetresonanz-Tomographen.
Bei einem Magnetresonanz-Tomographen wird die
Funktion der einzelnen Anlagenkomponenten wie der starke Magnet, die magnetischen
Gradientenfelder, der Hochfrequenzsender, der Hochfrequenzempfänger,
die Signalverarbeitungsanlage und die Auswerte- und Dokumentationseinheit
über die Bedienkonsole und den zentrale Rechner gesteuert.
5.1. Magnet
Der Magnet besteht in der Regel
aus einem supraleitenden Elektromagneten, der mit flüssigem Stickstoff
und flüssigem Helium gekühlt wird. Auf diese Weise kann ein starkes
statisches Magnetfeld mit hoher Feldhomogenität erzeugt werden. Das
statische Magnetfeld dient zur Polarisation der Kernspins und bildet die
Grundvoraussetzung für den Magnetresonanzvorgang.
5.2. Magnetische Gradienten
Die magnetischen Gradienten werden
durch zusätzliche veränderliche Elektromagneten in allen drei
Raumebenen erzeugt. Die Gradientenfelder überlagern sich dem statischen
Grundmagnetfeld und sind schnell steuerbar. Die Grössenordnung der magnetischen
Gradientenfelder beträgt nur circa ein Prozent des statischen Magnetfeldes.
Die magnetischen Gradienten werden zur Ortskodierung der Magnetresonanzsignale
benötigt.
5.3. Hochfrequenzsender
Mit Hilfe des Hochfrequenzsenders
wird die für den Magnetresonanzvorgang notwendige Anregungsenergie
auf die Kernspins übertragen. Die Frequenz des Hochfrequenzsenders ist
auf die Resonanzfrequenz der Kernspins abstimmbar. Die erforderliche Leistung
des Hochfrequenzsenders kann in der Grössenordnung von mehreren tausend
Watt liegen.
5.4. Hochfrequenzempfänger
Die Resonanzsignale (Radiowellen)
der Kernspins werden durch einen Hochfrequenzempfänger registriert.
Der Hochfrequenzempfänger besteht in der Regel aus einer in einen Schwingkreis
integrierten Spule, die in die Nähe der zu untersuchenden Probe gebracht
wird. Der Schwingkreis muss vor jeder Untersuchung wie ein Radiogerät
auf die Resonanzfrequenz abgestimmt werden. In der Spule werden durch die
wechselnden Magnetfelder der Kernspins Spannungen induziert, die weiterverarbeitet
werden können.
5.5. Signalverarbeitung
Dem Hochfrequenzempfänger
ist eine Signalverarbeitung nachgeschaltet. Die sehr kleinen Signale in
der Grössenordnung von einigen Mikrovolt müssen zuerst verstärkt
werden. Dann erfolgt eine Demodulation der Niederfrequenzsignale aus dem
Hochfrequenzsignal. Die Niederfrequenzsignale enthalten die Informationen
der Ortskodierung. Die Niederfrequenzsignale werden für die Verrechnung
im Computer digitalisiert, d.h. die kontinuierlichen analogen elektrischen
Spannungen werden in zeitdiskrete binäre Zahlenwerte computergerecht
übersetzt. Die Transformation der Magnetresonanzsignale in Bilddaten
erfolgt digital im Computer.
5.6. Rechenanlage
Der Rechenanlage kommt in einer
Magnetresonanz-Anlage eine zentrale Bedeutung zu. Der Rechner dient nicht
nur zur Verrechnung und Nachbearbeitung der Magnetresonanzsignale, sondern
ist für die Steuerung und Synchronisation aller Anlagenkomponenten
zuständig. Zwischen der Rechenanlage und den oben genannten Anlagenkomponenten
bestehen Kommunikationsschnittstellen, über die die Funktionen der magnetischen
Gradientenfelder, des Hochfrequenzsenders, des Hochfrequenzempfängers,
der Signalverarbeitungsanlage und der Auswerte- und Dokumentationseinheit
programmiert werden können. Das Speichersystem der Rechenanlage wird
auch zur Archivierung der Bildergebnisse verwendet.
5.7. Bedienkonsole, Auswerte- und Dokumentationseinheit
Die Bedienkonsole ist die Schnittstelle
der Magnetresonanzanlage zum Benutzer. Über die Bedienkonsole können
vom Personal Patientendaten eingegeben, Sequenzabläufe angewählt,
Messungen gestartet und Auswertungen der Bildergebnisse vorgenommen werden.
Die Bildergebnisse werden zur Dokumentation und Befundung in der Regel über
ein Kamerasystem auf Filmfolien abgelichtet. Die modernen
Kamerasysteme arbeiten mittels Laserbelichtung der Filme.
6.0. Paramagnetisches Kontrastmittel
Gd-DTPA
Das MR-Kontrastmittel Gadolinium-DTPA
wurde in den Jahren 1984 und 1985 kurz vor der Einführung der schnellen
Gradientenecho-Sequenzen erstmals klinisch eingesetzt.
Gadolinium(Gd)-DTPA ist ein
intravenös applizierbares Kontrastmittel zur Kontrastverstärkung
in der MRT. Seit der Einführung des Kontrastmittels Gd-DTPA und den
ersten klinischen Kontrastmittelanwendungen am Menschen im Jahr 1984
hat sich der Einsatz des Kontrastmittels Gd-DTPA in der MRT rasch durchsetzen
können. Inzwischen sind verbesserte Kontrastmittel mit noch geringerer
Osmolalität entwickelt worden.
Bei der kontrastmittelunterstützten
MRT intrakranieller Läsionen ist das Kontrastmittel Gd-DTPA in der
Lage, eine fehlende oder gestörte Blut-Hirn-Schranke über eine
Signalintensitätserhöhung auf T1-gewichteten Aufnahmen anzuzeigen.
Im gesunden Hirngewebe verhindert die Blut-Hirn-Schranke das Austreten des
Kontrastmittels in den Extrazellulärraum, wodurch eine Kontrastmittelanreicherung
im gesundem Hirngewebe ausbleibt. Der Kontrast zwischen erkrankten und gesunden
Hirngewebsarealen wird im Falle einer Blut-Hirn-Schrankenstörung durch
das Kontrastmittel erhöht. Obwohl eine mit der Blut-Hirn-Schranke vergleichbare
Barriere für das Kontrastmittel in anderen Geweben fehlt, weisen erkrankte
Gewebe in der Regel eine gesteigerte Affinität für das Kontrastmittel
auf, so dass Kontrastmittel in allen erkrankten Körperbereichen kontraststeigernd
wirken können.
Die wesentlichen Vorteile einer
Kontrastmittelgabe sind eine erhöhte Nachweisempfindlichkeit für
Läsionen (erhöhte Sensitivität) durch eine Verbesserung der
Bildkontraste, die Möglichkeit funktioneller Aussagen über die Blut-Hirn-Schranke
(erhöhte Spezifität) mit konsekutiv verbesserter Differenzierbarkeit
verschiedener Läsionen und die Möglichkeit der Messzeitverkürzung
in Verbindung mit schnellen Sequenzen. Aufgrund der Kontrastmittelempfindlichkeit
schneller Gradientenechosequenzen ist eine Kombination der schnellen Sequenzen
mit Kontrastmittelgabe günstig. Darüber hinaus sind unter Anwendung
moderner Messverfahren und der Applikation des Kontrastmittels im Bolus Aussagen
über die Durchblutung, die Vaskularisation und die Gefässpermeabilität
eines Gewebes möglich.
6.1. Physiko-chemische Eigenschaften
des Kontrastmittels Gd-DTPA
Das im Gd-DTPA enthaltene Gadolinium
ist ein Element, das zu den seltenen Erden gehört. Das dreiwertige
Gadoliniumion trägt sieben ungepaarte Elektronen und zeigt somit starke
paramagnetische Eigenschaften. Paramagnetisch bedeutet in diesem Zusammenhang,
dass die Wasserstoffprotonen in der Nähe des Gadoliniums einem verstärktem
Magnetfeld ausgesetzt sind, so dass der Energieaustausch bei der Magnetresonanz
beschleunigt wird. Gadolinium hat aufgrund seines Paramagnetismus einen verkürzenden
Effekt auf die T1-Relaxationszeit der Wasserstoffprotonen. Die Verkürzung
der T1-Relaxationszeit bei Anwesenheit von Gd-DTPA führt zu einer Signalintensitätssteigerung
und zu einer Kontrastverstärkung gegenüber den nicht kontrastmittelanreichernden
Geweben.
6.2. Pharmakologische Eigenschaften
Gd-DTPA ist ein hydrophiles,
extrem stabiles und biologisch inertes Komplexsalz (Dimeglumin-Gadopentetat),
das sich nach intravenöser Gabe rasch im Extrazellulärraum verteilt
und in unveränderter Form über die Nieren durch glomeruläre
Filtration ausgeschieden wird. Bei normaler Nierenfunktion ist das Kontrastmittel
nach Stunden nahezu vollständig wieder ausgeschieden. Eine entscheidende
Eigenschaft des Kontrastmittels Gd-DTPA für die Anwendung im zentralen
Nervensystem ist die Tatsache, dass es die intakte Blut-Hirn-Schranke nicht
passieren kann. Bei gestörter Blut-Hirn-Schranke tritt das Kontrastmittel
aus dem Gefässlumen in den Extrazellulärraum des Hirngewebes aus
und führt zu einer Kontrastierung des erkrankten Bereiches. Ein wesentlicher
diagnostischer Einsatzschwerpunkt des Gd-DTPA dient demzufolge dem Nachweis
einer gestörten Blut-Hirn-Schranke bei intrakraniellen und intraspinalen
Tumoren, Entzündungen und Infarkten.
6.3. Unverträglichkeiten und Nebenwirkungen
Unverträglichkeiten und
Nebenwirkungen des Kontrastmittels Gd-DTPA sind sehr selten und beschränken
sich auf zumeist leichte lokale Wärme- oder Schmerzgefühle im Zusammenhang
mit der Venenpunktion und der unmittelbaren Kontrastmittelinjektion.Aufgrund
der geringen Kontrastmittelmenge (in der Regel weniger als 20 ml) und der
geringen Osmolalität sind die magnetresonanztomographischen Kontrastmittel
im Vergleich zu den Röntgenkontrastmitteln besser verträglich.
Allergoide Reaktion können in vergleichbarer Weise wie bei Röntgenkontrastmitteln
auftreten. Bei Allergien gegen Röntgenkontrastmittel (Jodallergie)
kann sich eine Untersuchung mit einem magnetresonanztomographischen Kontrastmittel
anbieten, da keine Kreuzallergien zu erwarten sind.
6.4. Kontrastmittelapplikation
Das paramagnetische Kontrastmittel
wird intravenös applizert. In der Regel wird wie bei einer intravenösen
Spritze eine Armvene punktiert und das Kontrastmittel in die Armvene gegeben.
Das Kontrastmittelvolumen beschränkt sich in Abhängigkeit vom
Körpergewicht auf unter 20 Milliliter. Das Kontrastmittel verteilt sich
in der Blutbahn und im Extrazellulärraum und ist innerhalb von Minuten
wirksam.
7.0. Literatur: Magnetresonanzgrundlagen
- Bloch F: Nuclear Induction. Phys. Rev. 1946;
70:460-474
- Lauterbur PC: Image formation by induced
local interactions: examples employing nuclear magnetic resonance, Nature
1973; 242:190-191
- Lissner J, Seiderer M: Klinische Kernspintomographie,
Enke Verlag, Stuttgart, 1990
- Purcell EM,Torrey HC, Pound RV: Resonance
absorption by nuclear magnetic moments in a solid. Phys. Rev 1946; 69:37-38
- Ramm B, Semmler W, Laniado M: Einführung
in die MR-Tomographie, Enke Verlag, Stuttgart, 1986
- Reiser M, Semmler W: Magnetresonanztomographie.
Springer Verlag, Berlin, 1992; 1. Auflage
- Stark DD, Bradley WD: Magnetic Resonance
Imaging, Vol. 1 & 2 , Jr. Moshby Year Book, St. Louis, Baltimore, 1992
8.0. Verzeichnis
der verwendeten Abkürzungen
| alpha |
Hochfrequenzanregungswinkel |
| FLASH |
Fast Low Angle Shot, schnelle
Gradientenecho-Technik |
| FLASH40/10 |
FLASH-Sequenz mit TR 40
ms und TE 10 ms |
| Gd |
Gadolinium |
| Gd-DTPA |
Gadolinium-Diäthylentriaminpentaessigsäure |
| Gradient |
magnetisches Gradientenfeld,
das dem magnetischen Grundfeld überlagert ist |
| HF |
Hochfrequenz |
| KM |
Kontrastmittel |
| KRV |
Kontrast-zu-Rausch-Verhältnis |
| KST |
Kernspintomographie |
| MSGE |
Mehrschichtgradientenechosequenz |
| MR |
Magnetresonanz |
| MRT |
Magnetresonanztomographie |
| ROI |
Region of Interest (Messfeld) |
| SE |
Spinecho |
| SE500/15 |
Spinecho-Sequenz mit TR
500 ms und TE 15 ms |
| S |
Signalintensität |
| SRV |
Signal-zu-Rausch-Verhältnis |
| T1 |
longitudinale Relaxationszeit
T1 |
| T2 |
transversale Relaxationszeit
T2 |
| TE |
time echo delay, Echoausleseverzögerung |
| TR |
time repetition, Pulswiederholzeit |